基因敲入细胞系(KI)
立即咨询通过核转染法将gRNA、Cas9 和Donor 共转入细胞中,进行药筛,药筛完成后挑选单克隆培养。选择不同的克隆分别进行靶位点扩增及测序,筛选出敲入纯合的阳性克隆。
艾森生物提供多种类型的基因敲入服务,荧光蛋白定点敲入、蛋白标签定点敲入、HiBiT定点敲入等等均可构建。
一、KI细胞敲入定制服务
基因敲入细胞服务详情,超300种细胞成功案例!
| 细胞类型 | 常规细胞系、肿瘤细胞系、IPS/ES等各类细胞 |
|---|---|
| 服务类型 | 荧光/蛋白标等 |
| 交付成果 | 阳性克隆 |
| 周期/价格 | 在线咨询;添加官方微信号:18520176000(手机同号) |
二、基因敲入细胞方案
(1) 特定位点融合蛋白:
gRNA 和Cas9 复合物造成靶位点DNA 双链断裂后,细胞以外源携带敲入片段的Donor 作为模板进行同源重组修复(HDR), 将敲入片段重组到基因组靶位点。
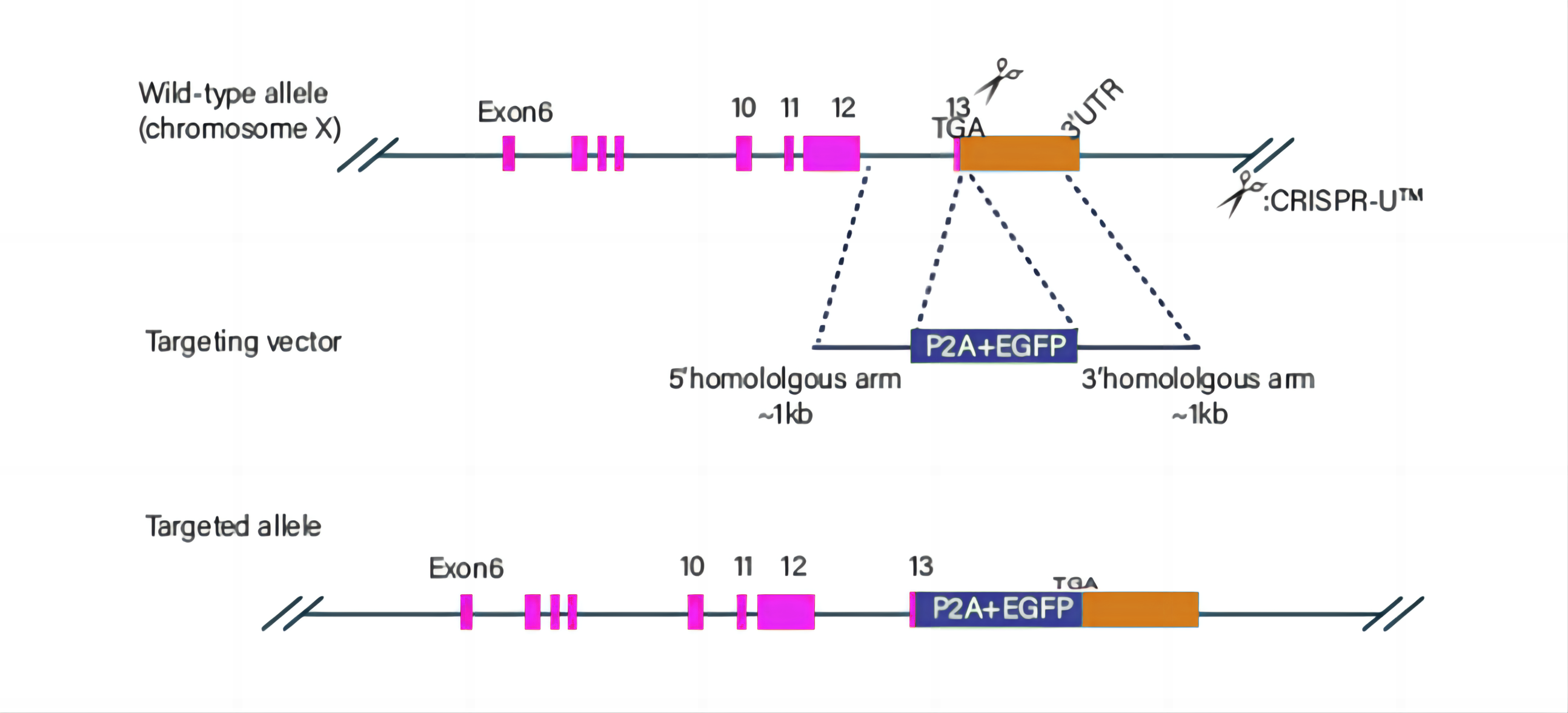
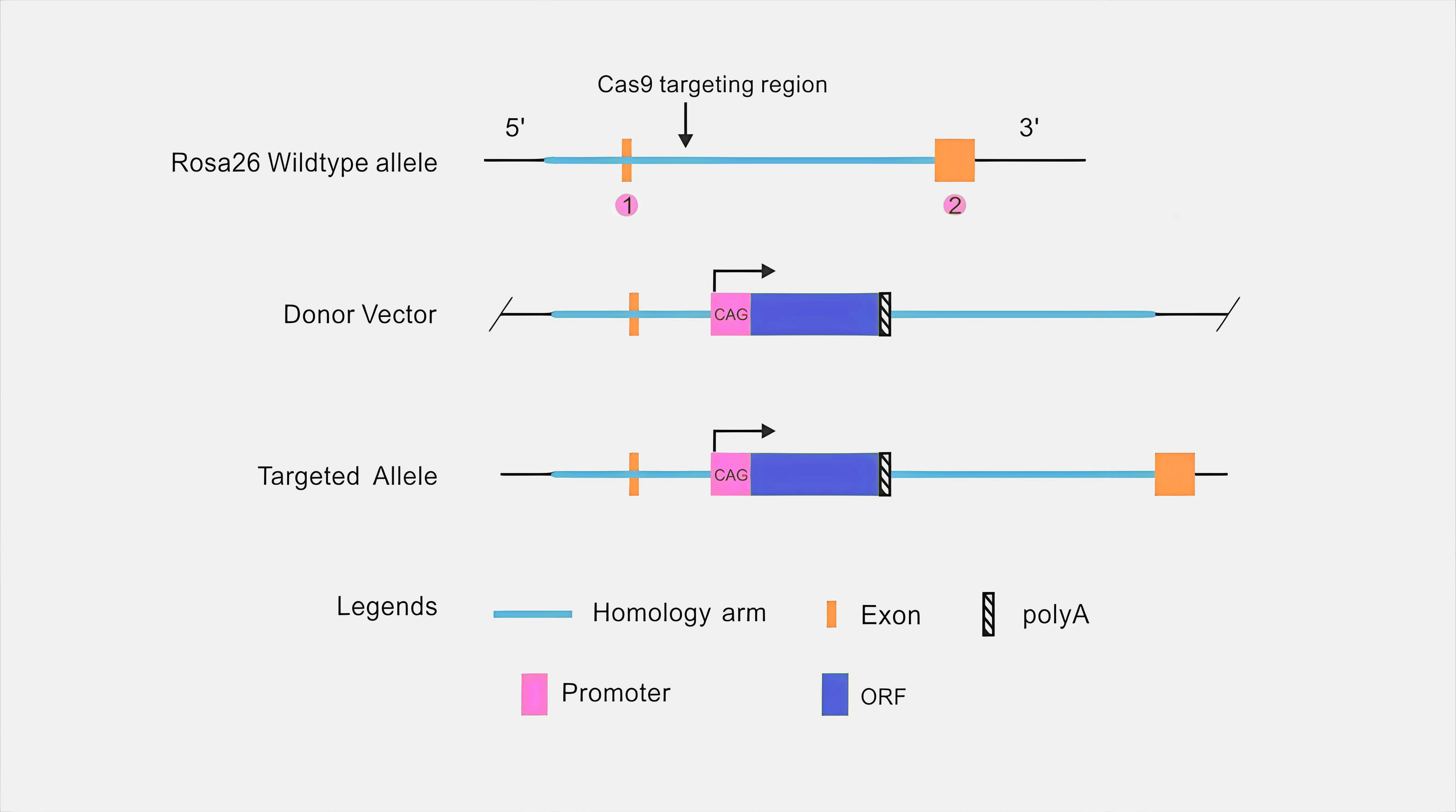
(2) 敲除特定基因同时敲入外来基因片段:
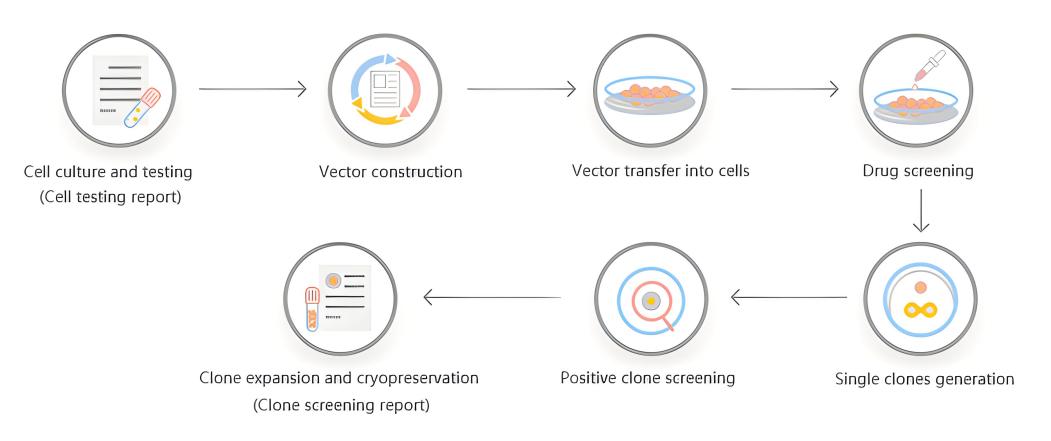
三、服务流程及质量控制
优化实验流程,有效提升编辑效率
基因/细胞分析→sgRNA设计与Donor构建→细胞电转及KO效果鉴定→单克隆化→测序分析→复检及扩增。
四、AI-CRISPR™技术优势
1. AI-CRISPR™技术优势:拥有更高的基因切割效率与同源重组效率,基因编辑效率提升10-20倍。
2. 成熟的技术平台:大量成功案例,在超300种细胞中成功实现超数千例基因编辑;可提供从细胞基因表达调控、细胞功能验证及表型分析的全流程服务。
3. 脱靶效率低:采用RNP递送,相比于质粒或者病毒等基因敲除方法,具有更高的特异性和编辑效率。其能准确靶向目的细胞,提高效率的同时减少非特异的切割;实现Cell pool/纯合子交付,快至6周。
4. 应用广泛:AI-CRISPR™基因编辑轻松实现基因 敲除/点突变/敲入;承诺项目失败全额退款,成功保障安全无忧。
5. 严格的质量控制体系:进行细菌、支原体等微生物的双重检测,确保100%无污染,并充分鉴定基因编辑效果;进行细胞活率检测,保证交付质量。
五、案例分析
1.BEAS-2B细胞背景
BEAS-2B细胞是从肺癌个体的正常人支气管上皮病理切片分离出的上皮细胞。这个细胞引种自ATCC CRL-9609,又可被称为支气管上皮细胞。BEAS-2B细胞系最初是通过使用腺病毒12-SV40杂交病毒感染,并通过连续细胞传代建立的永生化细胞系,它保留了对血清反应进行鳞关分化的能力,这种能力可用于筛选诱导或影响分化及致癌的化学或生物制剂,因此 BEAS-2B细胞被认为是研究药物代谢活化作用和呼吸系统肿瘤以及分子机制理想的细胞模型。
2.BEAS-2B的应用
BEAS-2B 细胞在成骨和成脂分化方面与 hMSCs 具有相似的潜力;将细胞分化诱导21天后,用油红染色分化脂肪细胞中的脂质液泡,然后使用茜素红染色分化骨细胞中的钙沉积。结果表明BEAS-2B和在成骨发生或脂肪发生方面均显示出几乎相同的阳性染色,这说明BEAS-2B 细胞能像hMSC1细胞一样能在诱导后表现出很强的骨细胞和脂肪细胞分化能力。
目前,BEAS-2B已被广泛用于研究肺癌发生的细胞和分子机制,其中包括上皮间质转化(EMT)在肺癌和肺炎球菌感染中的作用等。此外,BEAS-2B细胞系已被用作体外细胞模型,用于检测和筛选具有潜在肺毒性或肺部致癌性的各种化学和生物制剂。
3.使用AI-CRISPR™在BEAS-2B细胞中实现基因编辑
基因编辑和细胞模型的建立对于推进功能基因组学、信号通路、新陈代谢、细胞死亡、药物发现、药物反应和癌症研究等领域具有重要的意义。BEAS-2B细胞作为研究药物代谢活化作用和呼吸系统肿瘤以及分子机制的理想细胞模型,已经有许多研究人员利用CRISPR/Cas9技术对其进行编辑以研究癌症特征、耐药机制的披露、癌症治疗、细胞死亡研究、功能基因组学、信号通路、药物发现、药物反应和细胞治疗等多种具有重要意义的课题。
艾森生物研发的AI-CRISPR™(基于CRISPR/Cas9技术)在DNA双链的切割上比一般的CRISPR/Cas9系统更有效率,不仅可以显著提高同源重组的效率,还能同时在体内外实现高效的基因编辑,对于BEAS-2B细胞的基因编辑实验有着极大的优势。
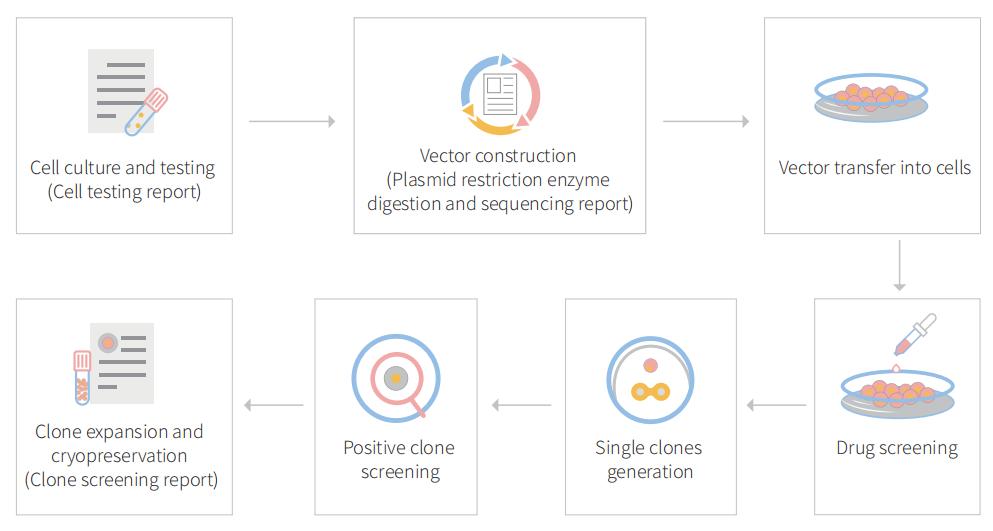
图1 使用AI-CRISPR™在BEAS-2B细胞中基因编辑过程
3.1 基因敲入或基因点突变BEAS-2B细胞系
BEAS-2B细胞通过电穿孔法与gRNA、Cas9和Donor载体共转染,然后挑单克隆。阳性克隆将通过测序进行验证。具体案例如下:
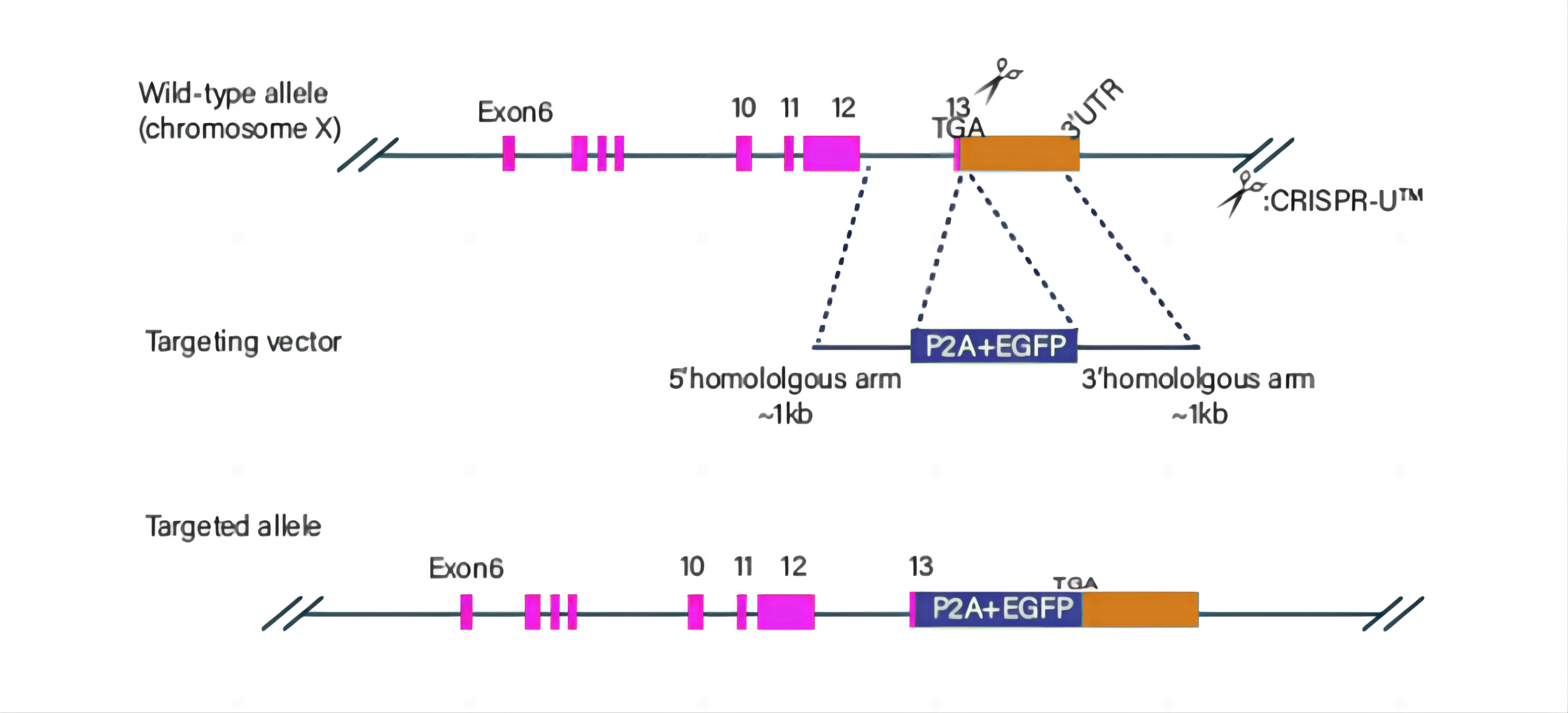
图3 BEAS-2B细胞系的敲入策略
(1)敲入案例
为了研究突变体NRASQ61K在血管再生中的特异性影响,在正常(非肿瘤)人支气管上皮细胞(BEAS-2B)中进行了敲入。与野生型(WT)细胞相比,在CAM上生长的NRASQ61K过表达细胞的特征是血管系统紊乱,并存在若干个出血区域。为了证实体内NRASQ61K的促血管生成作用,在裸鼠身上进行了Matrigel plug试验,结果如图5B中所示,NRASQ61K表达细胞显示出血管再生明显增加,呈亮红色。然而,野生型细胞中的血管再生可以忽略不计,并且血红蛋白水平较低。除此之外,研究者还发现NRASQ61K在体外的表达显著增加了类毛细管网络,如图5C所示。而肿瘤血管生成的关键所在正是细胞在骨髓上自发形成毛细血管样结构,因此,NRASQ61K的表达会在一定程度上促进肿瘤血管的生成。
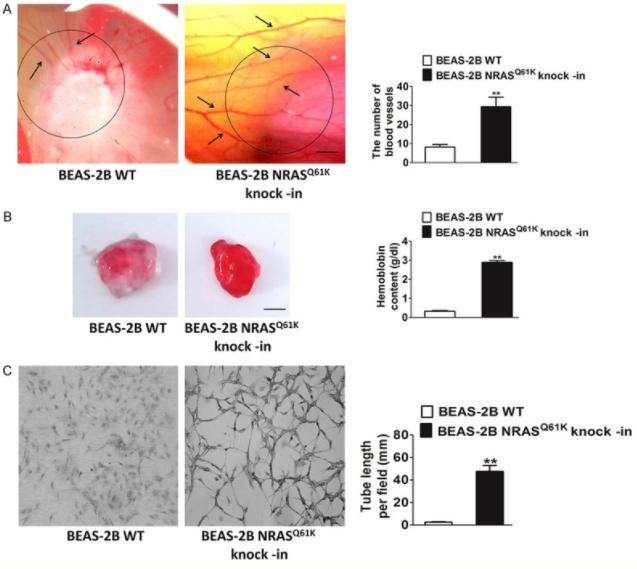
图5 将NRASQ61K敲入BEAS-2B细胞
参考文献:
[1]Liu, Shuang, et al. "miR-106b-5p targeting SIX1 inhibits TGF-β1-induced pulmonary fibrosis and epithelial-mesenchymal transition in asthma through regulation of E2F1." International Journal of Molecular Medicine 47.3 (2021): 1-1.
[2]Sawada J, Li F, Komatsu M. R-Ras protein inhibits autophosphorylation of vascular endothelial growth factor receptor 2 in endothelial cells and suppresses receptor activation in tumor vasculature. J Biol Chem. 2015;290:8133–8145
[3]He, Jun, et al. "Arsenic-induced metabolic shift triggered by the loss of miR-199a-5p through Sp1-dependent DNA methylation." Toxicology and applied pharmacology 378 (2019): 114606.
[4]Pircher A, Hilbe W, Heidegger I, Drevs J, Tichelli A, Medinger M. Biomarkers in tumor angiogenesis and anti-angiogenic therapy. Int J Mol Sci. 2011;12:7077–7099.
[5]Song, Zhaowei, Fenghai Liu, and Jie Zhang. "Targeting NRASQ61K mutant delays tumor growth and angiogenesis in non-small cell lung cancer." American journal of cancer research 7.4 (2017): 831.
[6]W.R. Chappell, B.D. Beck, K.G. Brown, R. Chaney, R. Cothern, C.R. Cothern, K.J. Irgolic, D.W. North, I. Thornton, T.A. Tsongas. Environ. Health Perspect., 105 (1997), pp. 1060-1067
[7]Ding, Jin, et al. "Cyclooxygenase-2 induction by arsenite is through a nuclear factor of activated T-cell-dependent pathway and plays an antiapoptotic role in Beas-2B cells." Journal of Biological Chemistry 281.34 (2006): 24405-24413.
[8]H.Y. Chiou, Y.M. Hsueh, K.F. Liaw, S.F. Horng, M.H. Chiang, Y.S. Pu, J.S. Lin, C.H. Huang, C.J. Chen. Cancer Res., 55 (1995), pp. 1296-1300
[9]Van Den Heuvel, Rosette, et al. "Identification of PM10 characteristics involved in cellular responses in human bronchial epithelial cells (Beas-2B)." Environmental research 149 (2016): 48-56.
