CRISPR文库定制服务
立即咨询CRISPR-gRNA文库是高通量筛选靶基因的重要工具,可用于大规模或全基因组功能筛选,涉及信号通路、疾病、细胞药物应答、发育、基因调控等方面。艾森生物在gRNA文库筛选方面拥有丰富的经验,能够帮助客户快速构建CRISPR KO(基因敲除)、CRISPRa(基因激活)文库、CRISPRi(基因抑制/沉默),也可以为客户提供全套的细胞功能筛选服务,涵括文库构建、病毒文库、细胞转染和筛选、NGS测序与数据分析服务。
一、CRISPR文库服务内容
| 服务内容 | 质量保证 | ||
|---|---|---|---|
| CRISPR文库构建 | ≥50ug质粒NGS检测报告 | 质量标准 | 覆盖度>99%,均一性<10 |
| 文库扩增 | 多种质粒规格,NGS检测报告(选做) | 质粒总量 | 50ug/100ug/500ug |
| 病毒包装 | 1mL/3ml/5mL ;1*10^8TU/mL | 病毒滴度 | ≥1*10^8TU/mL |
| 细胞筛选与NGS分析 | pool细胞NGS功能基因筛选报告 | NGS测序深度 | ≥300x |
二、CRISPR-Cas9文库应用方向
1. 药物靶点确定与验证:CRISPR-Cas9文库筛选技术可以应用于药物靶点筛选中,通过大规模筛选技术,系统的分析、验证一些与抗药性相关的基因,从而为疾病治疗提供相关的理论基础。
2. 基因环路上下游调控机制分析:CRISPR-Cas9文库筛选技术不仅可以用于编辑人类细胞蛋白编码基因,对于基因组中的调控元件也同样有效,利用这种方法可以对基因环路上下游调控机制进行分析。
3. 代谢通路调节机制分析:CRISPR-Cas9文库技术可以应用于动植物的代谢通路条件机制分析。
4. 病毒侵染宿主细胞的受体蛋白筛选:通过CRISPR-Cas9文库技术可以快速的对病毒侵染宿主细胞的受体蛋白进行筛选和鉴定,科学家就曾通过CRISPR-Cas9全基因组文库筛选技术,成功发现并证实LDLRAD3蛋白是委内瑞拉马脑炎病毒(VEEV)进入动物和人类细胞的受体,以及筛选出冠状病毒侵入宿主细胞的受体蛋白以及与新冠病毒相关正相关和负相关的重要基因。
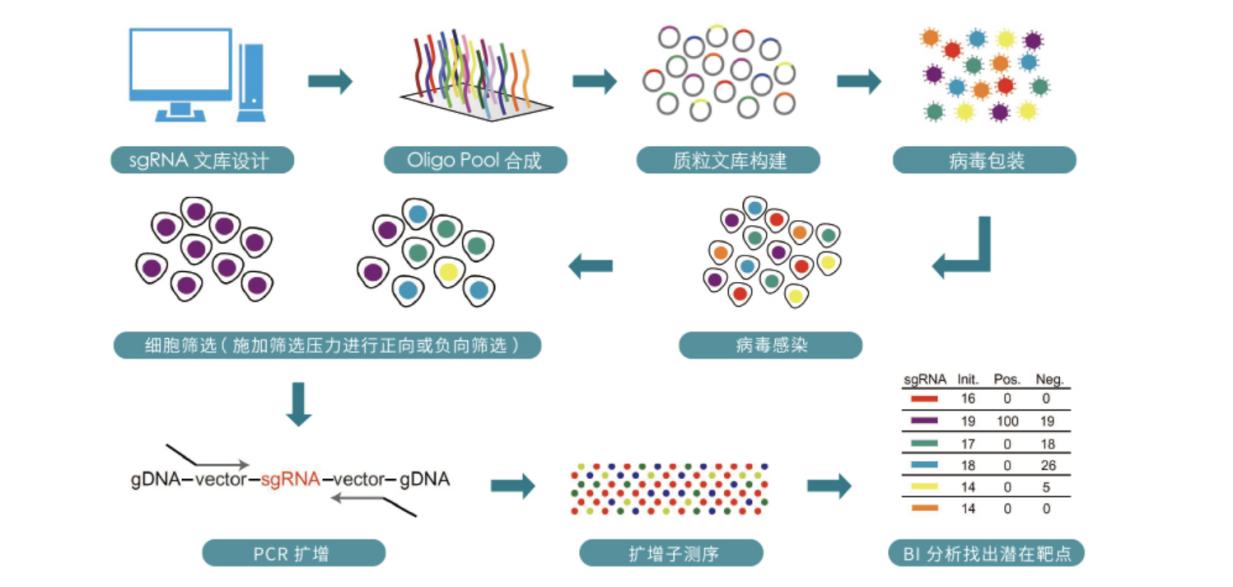
三、CRlSPR/Cas9 gRNA文库筛选流程
1. CRlSPR/Cas9 gRNA文库质粒构建;
2. CRlSPR/Cas9 gRNA文库质粒扩增;
3. CRlSPR/Cas9 gRNA文库慢病毒包装;
4. CRlSPR/Cas9 gRNA文库筛选;
5. PCR扩增和NGS测序、数据分析;
四、技术优势
1. 可设计任意NCBI数据库中存在的物种或基因的sgRNA
2. 可一次设计上万条sgRNAs
3. 可定制特定物种全基因组文库和亚文库
4. 特异性强
五、案例分析
科研中最关键也是最难的一步就是寻找靶点,筛选到一个新的靶点,就意味着一篇好的research article 诞生。作为强力的靶点筛选工具,CRISPR文库已经掀起了一波新的科研浪潮。小艾相信大家已经对CRISPR文库的基本原理以及操作流程有了一定的了解,但是高段位的同学早已不满于此,争相力求把CRISPR文库发挥得淋漓尽致,筛出精髓,卷出高分文章。作为你们的贴心小棉袄,小艾立马紧跟热点找了一篇今年发表在Nature上的CRISPR文库筛选案例,给大家分享一下顶刊的筛选思路!
《STING inhibits the reactivation of dormant metastasisinlung adenocarcinoma》
背景:从原位瘤脱落下来的肿瘤细胞在转移过程中绝大多数会被免疫系统消灭,但仍有少部分细胞逃过免疫系统的识别并且在其他器官中驻扎,进入休眠期,这类细胞称为播散性肿瘤细胞(disseminated tumor cell, DTC)。处于休眠期的DTC会下调NK细胞活性配体以及MHC-I的表达,以此来躲避NK细胞和T细胞的识别。在一段时间的休眠后,这些细胞会重启增殖进入转移初期(incipient metastasis)阶段,该阶段的DTC处于免疫逃逸以及易被免疫系统识别的平衡状态中。最终DTC逃过免疫系统识别,爆发性增殖,形成新的转移瘤(macrometastasis)。
该研究主要聚焦于找出抑制转移初期肿瘤细胞爆发的免疫因子。研究通过CRIPSRKO文库筛选免疫激活因子,比较转移初期与形成新的转移瘤后的细胞之间的差异,发现STING信号抑制了肺腺癌细胞的休眠转移再激活。
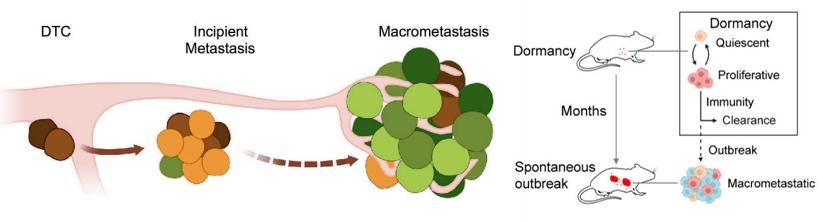
图1 肿瘤细胞转移逃逸模型[1,2]
这篇研究CRISPR文库筛选详细流程如下:
第一步: 设计sgRNA文库——根据研究目的定制针对性强的sgRNA文库(文库小而精)。
由于研究主要目的是为了寻找DTC能够实现免疫逃逸的相关基因,该研究的sgRNA文库主要围绕DTC细胞自身免疫激活相关基因进行设计。文献中设计的sgRNA包含3个部分,共涵盖220个基因:
1. NK细胞活性配体和MHC-I相关基因(DTC会通过二者被NK细胞和T细胞识别与杀伤);
2. 干扰素α/γ以及补体系统相关基因(scRNA-Seq比较转移早期细胞和爆发后细胞之间DEGs,并通过GSEA分析发现这些信号通路显著富集);
3. STING、RNA以及脂多糖信号通路基因(这些通路位于干扰素α上游)。
4. 为了确保文库细胞注射到小鼠体内的代表性,研究团队将上述基因分为若干个亚文库(每个亚文库靶向20个基因,每个基因设计5条sgRNA)
第二步:文库转染
该研究采用人早期肺腺癌细胞系(H2087-LCC和KPad1)。为确保文库细胞的高代表性,研究采用MOI = 0.3,覆盖度>1000x的条件,通过慢病毒转染的方式将亚文库分别转入不同细胞群中。经嘌呤霉素(2.5 μg/mL,4天)抗性筛选后,获得不同亚文库转染细胞。
第三步:制定合适的筛选方案
1)将小鼠肿瘤模型与流式细胞术相结合,筛选靶细胞;2)两种不同细胞的平行实验,增加实验结果说服力。
该研究旨在找出转移初期癌细胞到爆发期细胞之间的差异。团队早期研究表明,将早期肺腺癌细胞注入免疫缺陷小鼠中会使其转移至多器官并快速爆发增殖。因此选择将早期肺腺癌细胞注射至免疫缺陷小鼠中,促使其爆发。再通过流式细胞术分选出不同器官中已爆发的癌细胞,进行后续实验。
① 细胞类型:早期肺腺癌细胞(H2087-LCC和KPad1)
② 实验模型:免疫缺陷小鼠
③ 比较对象:转移早期DTC(对照组)和爆发后DTC(实验组)
④ 处理条件:心脏注射或尾静脉注射细胞,活体成像观察细胞生长状态,直至其爆发
⑤ 筛选方式:收取不同组织,通过流式细胞术分选带荧光标记的肿瘤细胞
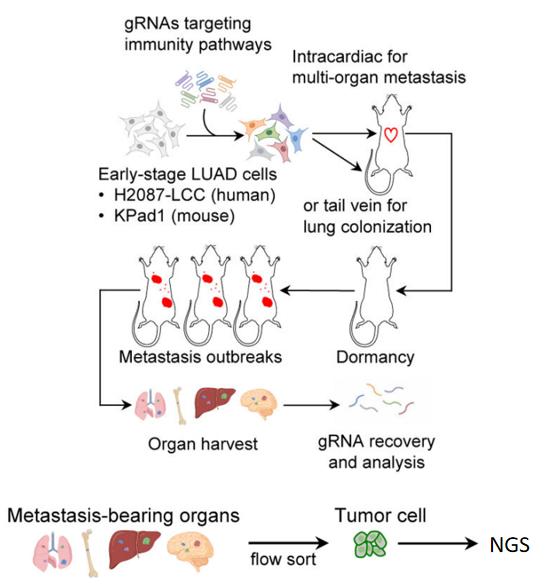
图2 CRISPR文库筛选流程图[1]
第四步:生信分析寻找靶基因——两平行实验组测序结果的比较分析,找到共同靶点。
通过生信比较分析不同组织中实验组和对照组的sgRNA差异,研究者发现NK细胞活性配体和MHC-1对应的sgRNA富集程度最高;由于已有研究表明NK细胞和T细胞抑制休眠期细胞的转移,说明筛选结果的可靠性。进一步组合分析比较两种早期肺腺癌细胞之间的sgRNA差异,研究者发现,STING信号以及STING信号下游基因都是sgRNA的主要靶点。
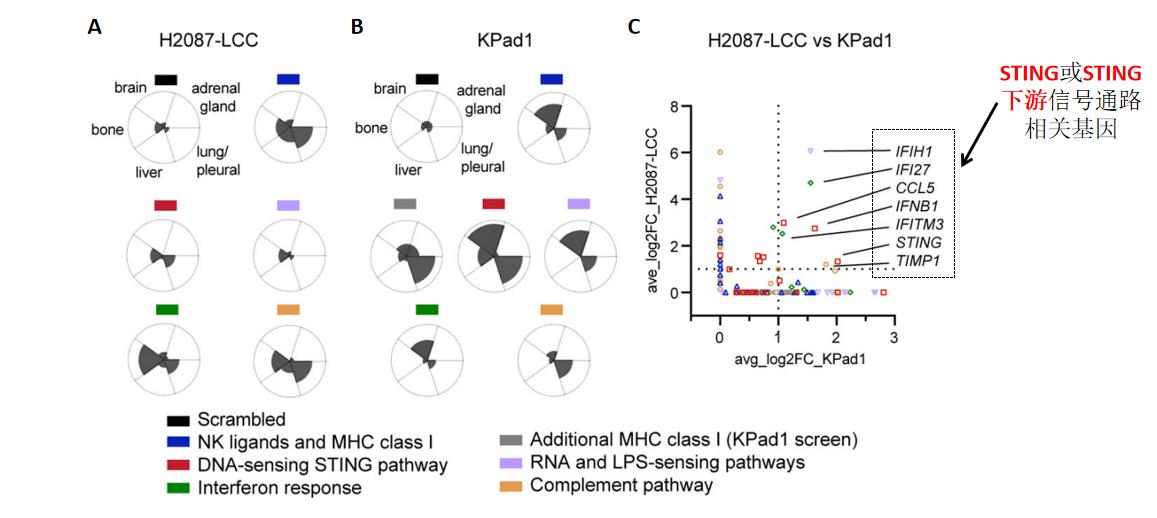
图3 生信分析筛选靶点[1]
A. H2087-LCC细胞注射组,不同组织中sgRNA富集程度;B. Kpad1细胞注射组,不同组织中sgRNA富集程度;C. 上述两组细胞的sgRNA富集分析。
第五步:靶点验证
作者首先借助免疫荧光确认了STING信号在转移初期的肺腺癌细胞中表达显著上调,随后分别通过Sting基因敲除以及过表达分别在免疫缺陷小鼠上证明STING信号与转移初期肿瘤细胞再激活之间的关系。抑制STING信号会促进转移初期肿瘤细胞的爆发性增殖,而增强STING信号则能减缓其增殖。
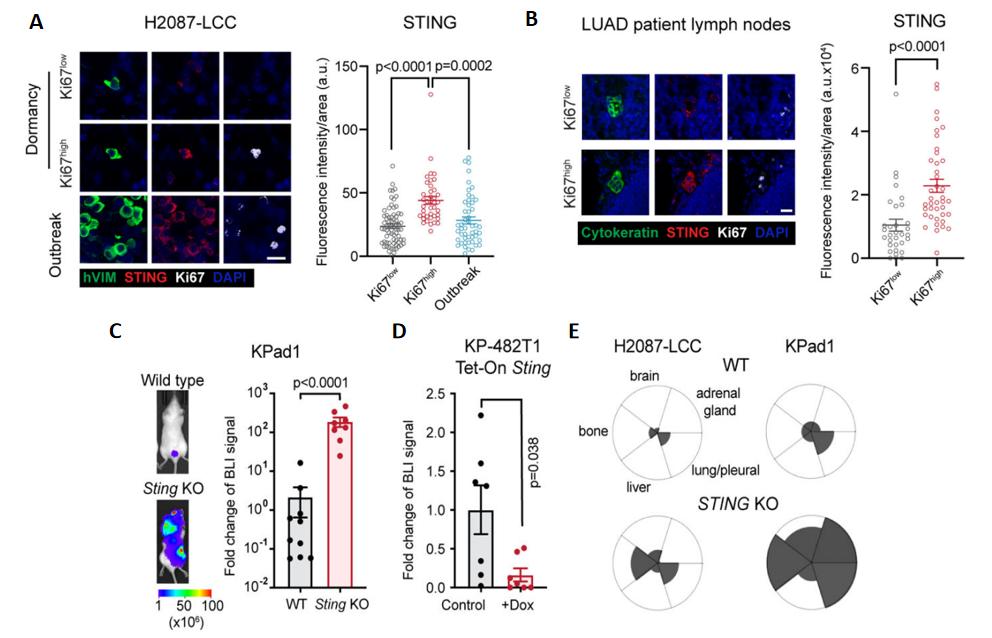
图四 STING靶点验证[1]
A&B. 两种细胞中STING信号强度对比。相较于休眠期细胞(Ki67low),转移初期细胞(Ki67high)的STING信号显著增加;C. 敲除KPad1细胞中Sting基因后,肿瘤细胞增殖显著增加;D. Tet-On系统过表达Sting基因后,肿瘤细胞增殖被显著抑制;E. 敲除Sting基因后,各器官中的肿瘤细胞均明显增殖。
总结:进行CRISPR文库筛选的步骤:1)选择sgRNA文库;目前市面上提供全基因组文库和靶向多种信号通路的亚文库可以满足大部分科研人的需求,当然也可以根据自己的实验需求定制文库(如通过RNA-Seq筛选出的DEGs,KEGG、GO、GSEA分析等找出候选基因群)。2)制定筛选方案;根据自身实验需求,考虑药物筛选条件(浓度、时间)、细胞筛选方式(阳/阴性筛选、体内/外筛选、流式分选)以及比较对象(实验组和对照组)等因素,制定合理的筛选方案。3)生信分析;通过比较实验组和对照组之间的差异基因富集程度筛选潜在靶点。4)通过基因敲除或过表达细胞进行靶点功能验证,亦或是下游信号通路机制的进一步研究。
参考文献:
[1] Hu, J., Sánchez-Rivera, F.J., Wang, Z. et al. STING inhibits the reactivation of dormant metastasis in lung adenocarcinoma. Nature 616, 806–813 (2023).
[2] Laughney, A.M., Hu, J., Campbell, N.R. et al. Regenerative lineages and immune-mediated pruning in lung cancer metastasis. Nat Med 26, 259–269 (2020).
